مقدمة في إدارة مخاطر الأجهزة الطبية
تتضمن إدارة مخاطر الأجهزة الطبية ، وهي جانب مهم من جوانب تطوير المنتجات في صناعة الرعاية الصحية ، تحديد المخاطر المحتملة المرتبطة بالجهاز ، وتقدير وتقييم المخاطر المرتبطة بها ، والتحكم في هذه المخاطر ، ومراقبة فعالية الضوابط الموضوعة. هذه العملية حاسمة في ضمان سلامة وفعالية الأجهزة الطبية. إدارة مخاطر الأجهزة الطبية هي عملية شاملة لدورة الحياة تساعد في اتخاذ قرارات مستنيرة بشأن سلامة الأجهزة الطبية.
إن عملية إدارة مخاطر الأجهزة الطبية ليست حدثا لمرة واحدة ولكنها عملية مستمرة تبدأ من تصور المنتج وتستمر خلال دورة حياته. من الضروري إجراء تقييم وإعادة تقييم مستمر للمخاطر المرتبطة بجهاز طبي. قد تؤثر عوامل مثل المعلومات السريرية الجديدة والتقدم التكنولوجي والتغييرات في المتطلبات التنظيمية والتعليقات الواردة من المستخدمين على ملف تعريف مخاطر الجهاز.
ومع ذلك ، فإن إدارة مخاطر الأجهزة الطبية لا تتعلق فقط بتحديد المخاطر والتحكم فيها. كما أنه ينطوي على موازنة المخاطر مقابل فوائد الجهاز. الهدف النهائي هو التأكد من أن فوائد الجهاز الطبي تفوق مخاطره ، دون المساس بسلامة المرضى أو أداء الجهاز.
أهمية ISO 14971 في إدارة مخاطر الأجهزة الطبية
يوفر ISO 14971 ، وهو معيار رئيسي في مجال إدارة مخاطر الأجهزة الطبية ، إطارا لإدارة المخاطر المتعلقة بالأجهزة الطبية. هذا المعيار معترف به عالميا وأصبح جزءا أساسيا من عملية تطوير المنتجات في صناعة الرعاية الصحية. يوفر نهجا منظما لتحديد المخاطر وتقدير وتقييم المخاطر المرتبطة بها والسيطرة على هذه المخاطر ومراقبة فعالية الضوابط.
يضمن تطبيق ISO 14971 في إدارة مخاطر الأجهزة الطبية أن الجهاز الطبي يلبي أعلى معايير السلامة. يساعد الشركات المصنعة على الكشف بشكل منهجي عن السيناريوهات التي قد تؤدي إلى إصابة أو ضرر ، مما يمكنهم من تصميم منتجات أكثر أمانا. إلى جانب ذلك ، فإنه يوفر نهجا منظما لإدارة المخاطر يمكن تدقيقه ، وهو أمر بالغ الأهمية في إثبات الامتثال للمتطلبات التنظيمية.
لا تؤكد ISO 14971 على أهمية اتباع نهج قائم على المخاطر لتصميم وتطوير الأجهزة الطبية فحسب ، بل تسلط الضوء أيضا على حاجة الشركات المصنعة إلى إنشاء عملية لإدارة المخاطر. وينبغي إدماج هذه العملية في نظام إدارة الجودة في المنظمة وينبغي أن تكون متسقة مع السياسة العامة للمنظمة وأهدافها.
فهم عملية إدارة المخاطر ISO 14971
تعد عملية إدارة المخاطر ISO 14971 نهجا شاملا ومنهجيا واستباقيا لتحديد المخاطر وتقييمها والتحكم فيها ومراقبتها طوال دورة حياة الجهاز الطبي. تتضمن العملية عدة خطوات رئيسية ، بما في ذلك
- تحليل المخاطر ،
- تقييم المخاطر،
- السيطرة على المخاطر، و
- معلومات الإنتاج وما بعد الإنتاج.
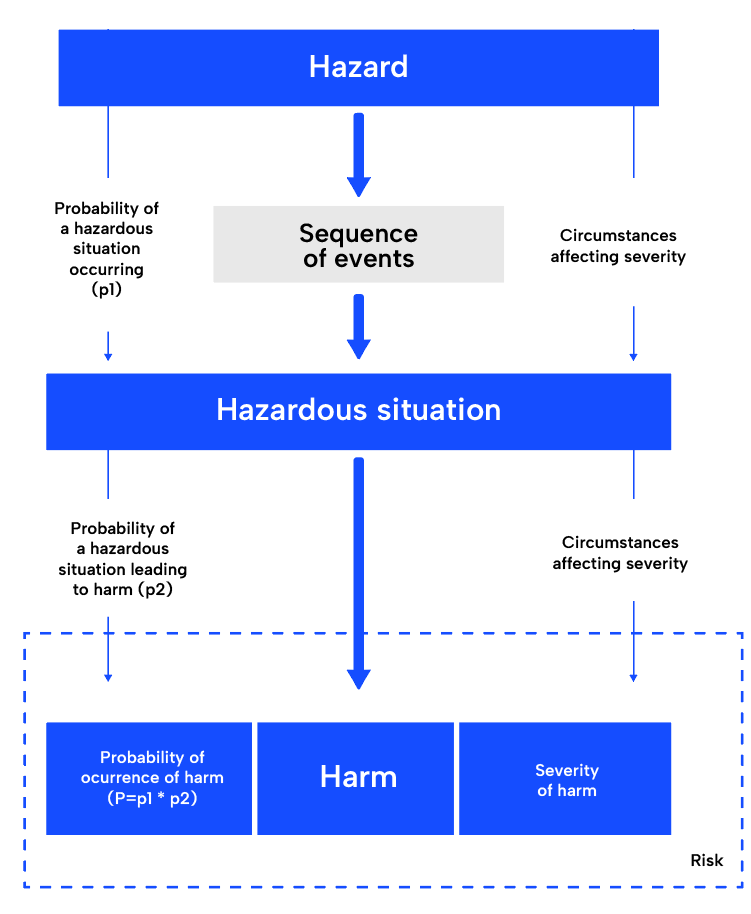
تحليل المخاطر:
تتضمن الخطوة الأولى في عملية إدارة المخاطر ISO 14971 ، تحليل المخاطر ، فهم الاستخدام المقصود للجهاز الطبي وتحديد المخاطر المحتملة. يتطلب فهما شاملا للجهاز والاستخدام المقصود منه والمخاطر المحتملة التي قد تنشأ أثناء استخدامه. بمجرد تحديدها ، سيتم اشتقاق المواقف الخطرة المحتملة والأضرار. أداة شائعة هي وضع الفشل وتحليل الآثار (FMEA). إنه عملي للغاية ، لأنه يوفر بالفعل هيكلا يتبع هذا النهج.
تقييم المخاطر:
تتضمن الخطوة التالية ، تقييم المخاطر ، تحديد شدة واحتمال كل خطر محدد وتحديد ما إذا كان مقبولا أو يحتاج إلى مزيد من تدابير الرقابة.
السيطرة على المخاطر:
تتضمن السيطرة على المخاطر ، وهي الخطوة التالية في العملية ، تطوير استراتيجيات للتخفيف من المخاطر غير المقبولة أو تقليل المخاطر المقبولة بشكل أكبر. قد تتضمن هذه الاستراتيجيات تغييرات في تصميم الجهاز ، وتوفير تدابير وقائية في الجهاز الطبي نفسه أو عملية التصنيع ، وتوفير معلومات للمستخدمين حول المخاطر.
التقييم العام للمخاطر المتبقية
بمجرد وضع جميع استراتيجيات تخفيف المخاطر وتأكيدها ، يتعين على الشركة المصنعة تقييم إجمالي المخاطر المتبقية المرتبطة بالجهاز الطبي. يجب أن يأخذ هذا التقييم في الاعتبار جميع المخاطر المتبقية ومقارنتها بفوائد الاستخدام المقصود. وينبغي أن تكون منهجية ومعايير مقبولية المخاطر المتبقية الإجمالية على النحو المحدد في خطة إدارة المخاطر. في الحالات التي يعتبر فيها إجمالي المخاطر المتبقية مقبولا ، تكون الشركة المصنعة ملزمة بإخطار المستخدمين بأي مخاطر متبقية كبيرة. علاوة على ذلك ، يجب عليهم تقديم المعلومات اللازمة في الوثائق ذات الصلة للإبلاغ عن هذه المخاطر المتبقية.
مرحلة ما بعد السوق:
تتضمن الخطوة الأخيرة في العملية ، معلومات الإنتاج وما بعد الإنتاج ، مراقبة الجهاز الطبي بعد طرحه في السوق لضمان استمراره في تلبية متطلبات السلامة. هذه المرحلة حاسمة ، لأنها ستوفر بيانات في الوقت الفعلي للجهاز الخاص. تعد عملية مراقبة ما بعد السوق التي تم إعدادها بشكل صحيح مهمة لتوفير بيانات قوية لتغذية عملية إدارة المخاطر.
أهمية تحليل مخاطر الأجهزة الطبية
يتضمن تحليل مخاطر الأجهزة الطبية ، وهو مكون مهم في عملية إدارة مخاطر ISO 14971 ، تحديد وتحليل المخاطر المحتملة المرتبطة بجهاز طبي. هذه العملية حاسمة في ضمان سلامة وفعالية الجهاز.
يساعد تحليل المخاطر في تحديد مصادر الضرر المحتملة المرتبطة بالجهاز. يمكن أن تنشأ هذه من الجهاز نفسه ، أو من طريقة استخدامه ، أو من البيئة التي يتم استخدامه فيها. من خلال تحديد هذه المخاطر في وقت مبكر من عملية التصميم ، يمكن للمصنعين اتخاذ خطوات للقضاء عليها أو تخفيفها ، وبالتالي منع الحوادث التي قد تؤدي إلى ضرر.
يلعب تحليل المخاطر أيضا دورا حاسما في عملية تقييم المخاطر. من خلال توفير معلومات مفصلة حول المخاطر المحتملة والمخاطر المرتبطة بها ، فإنه يمكن الشركات المصنعة من اتخاذ قرارات مستنيرة حول قبول هذه المخاطر والحاجة إلى تدابير التحكم في المخاطر. يوفر ISO 14971 في مرفقاته إرشادات واضحة لتحديد المخاطر المحتملة بشكل منهجي.
تطبيق إدارة المخاطر 14971 في تصميم المنتجات
يضمن تنفيذ إدارة المخاطر 14971 في تصميم المنتج تصميم الأجهزة الطبية مع مراعاة السلامة. يوفر معيار ISO 14971 إطارا شاملا لإدارة المخاطر طوال عملية تصميم المنتج ، من المفهوم الأولي إلى المنتج النهائي.
يتضمن تنفيذ إدارة المخاطر 14971 في تصميم المنتج دمج عملية إدارة المخاطر في عملية التصميم والتطوير. ويشمل ذلك تحديد المخاطر المحتملة في وقت مبكر من عملية التصميم ، وتقدير وتقييم المخاطر المرتبطة بها ، وتطوير تدابير التحكم في المخاطر ، ومراقبة فعالية هذه التدابير.
من خلال دمج إدارة المخاطر في عملية تصميم المنتج ، يمكن للمصنعين التأكد من أن اعتبارات السلامة جزء لا يتجزأ من عملية التصميم. هذا لا يؤدي فقط إلى منتجات أكثر أمانا ولكن أيضا يقلل من احتمالية سحب المنتجات ومطالبات المسؤولية.
استنتاج
في الختام ، يلعب معيار ISO 14971 دورا مهما في إدارة مخاطر الأجهزة الطبية. يوفر إطارا شاملا لإدارة المخاطر المرتبطة بالأجهزة الطبية ، من التصميم الأولي إلى المنتج النهائي. من خلال تشجيع نهج استباقي قائم على المخاطر لتصميم المنتج ، فإنه يساعد الشركات المصنعة على تصميم أجهزة طبية آمنة وفعالة.
لا يضمن تطبيق معيار ISO 14971 في تصميم المنتج سلامة الأجهزة الطبية فحسب ، بل يساهم أيضا في نجاحها. من خلال تحديد المخاطر والتحكم فيها في وقت مبكر من عملية التصميم ، يمكن للمصنعين منع الحوادث التي قد تؤدي إلى ضرر ، وبالتالي تقليل احتمالية سحب المنتجات ومطالبات المسؤولية. علاوة على ذلك ، من خلال تقييم المخاطر المرتبطة بالجهاز مقابل الفوائد التي يوفرها ، يمكن للمصنعين اتخاذ قرارات مستنيرة تساهم في نجاح المنتج.




