Introduction à la gestion des risques liés aux dispositifs médicaux
La gestion des risques liés aux dispositifs médicaux, un aspect essentiel du développement des produits dans l’industrie des soins de santé, implique l’identification des dangers potentiels associés à un dispositif, l’estimation et l’évaluation des risques associés, la maîtrise de ces risques et le suivi de l’efficacité des contrôles mis en place. Ce processus est essentiel pour garantir la sécurité et l’efficacité des dispositifs médicaux. La gestion des risques liés aux dispositifs médicaux est un processus complet, axé sur le cycle de vie, qui permet de prendre des décisions éclairées sur la sécurité des dispositifs médicaux.
Le processus de gestion des risques liés aux dispositifs médicaux n’est pas un événement ponctuel, mais un processus continu qui commence dès la conception d’un produit et se poursuit tout au long de son cycle de vie. Il est nécessaire d’évaluer et de réévaluer en permanence les risques associés à un dispositif médical. Des facteurs tels que de nouvelles informations cliniques, des avancées technologiques, des modifications des exigences réglementaires et le retour d’information des utilisateurs peuvent affecter le profil de risque d’un dispositif.
La gestion des risques liés aux dispositifs médicaux ne se limite toutefois pas à l’identification et au contrôle des risques. Il s’agit également de mettre en balance les risques et les avantages d’un dispositif. L’objectif ultime est de s’assurer que les avantages d’un dispositif médical l’emportent sur ses risques, sans compromettre la sécurité du patient ou les performances du dispositif.
Importance de la norme ISO 14971 pour la gestion des risques liés aux dispositifs médicaux
L’ISO 14971, une norme clé dans le domaine de la gestion des risques liés aux dispositifs médicaux, fournit un cadre pour la gestion des risques liés aux dispositifs médicaux. Cette norme est reconnue au niveau mondial et est devenue un élément essentiel du processus de développement des produits dans l’industrie des soins de santé. Il fournit une approche systématique de l’identification des dangers, de l’estimation et de l’évaluation des risques associés, de la maîtrise de ces risques et de la surveillance de l’efficacité des contrôles.
La mise en œuvre de la norme ISO 14971 dans la gestion des risques liés aux dispositifs médicaux garantit qu’un dispositif médical répond aux normes de sécurité les plus élevées. Il aide les fabricants à découvrir systématiquement les scénarios susceptibles d’entraîner des blessures ou des dommages, ce qui leur permet de concevoir des produits plus sûrs. En outre, il fournit une approche structurée de la gestion des risques qui peut faire l’objet d’un audit, ce qui est essentiel pour démontrer la conformité avec les exigences réglementaires.
La norme ISO 14971 souligne non seulement l’importance d’une approche fondée sur le risque pour la conception et le développement des dispositifs médicaux, mais aussi la nécessité pour les fabricants de mettre en place un processus de gestion des risques. Ce processus doit être intégré au système de gestion de la qualité de l’organisme et doit être cohérent avec la politique et les objectifs généraux de l’organisme.
Comprendre le processus de gestion des risques de la norme ISO 14971
Le processus de gestion des risques ISO 14971 est une approche globale, systématique et proactive de l’identification, de l’évaluation, du contrôle et de la surveillance des risques tout au long du cycle de vie d’un dispositif médical. Le processus comprend plusieurs étapes clés, notamment
- l’analyse des risques,
- l’évaluation des risques,
- le contrôle des risques, et
- des informations sur la production et la post-production.
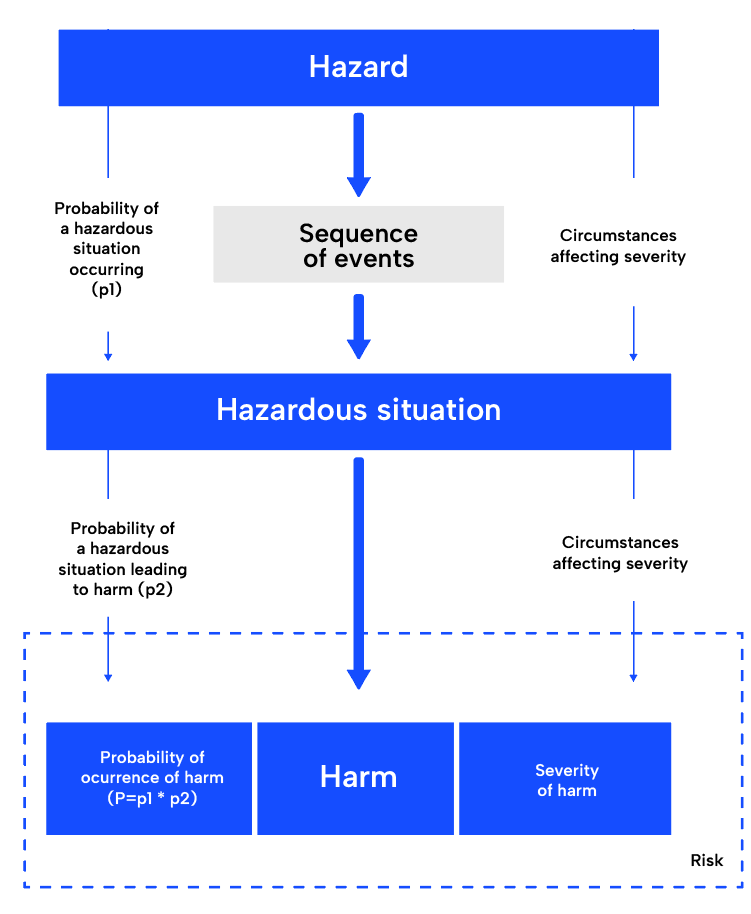
Analyse des risques :
La première étape du processus de gestion des risques de la norme ISO 14971, l’analyse des risques, consiste à comprendre l’utilisation prévue du dispositif médical et à identifier les dangers potentiels. Elle nécessite une connaissance approfondie de l’appareil, de son utilisation prévue et des dangers potentiels qui peuvent survenir lors de son utilisation. Une fois identifiées, les situations potentiellement dangereuses et les préjudices seront déterminés. Un outil courant est l’analyse des modes de défaillance et de leurs effets (AMDE). Il est très pratique, car il fournit déjà une structure qui suit cette approche.
Évaluation des risques :
L’étape suivante, l’évaluation des risques, consiste à déterminer la gravité et la probabilité de chaque risque identifié et à décider s’il est acceptable ou s’il nécessite des mesures de contrôle supplémentaires.
Contrôle des risques :
Le contrôle des risques, l’étape suivante du processus, consiste à élaborer des stratégies visant à atténuer les risques inacceptables ou à réduire davantage les risques acceptables. Ces stratégies peuvent inclure des changements dans la conception du dispositif, des mesures de protection dans le dispositif médical lui-même ou dans le processus de fabrication, et la fourniture d’informations aux utilisateurs sur les risques.
Évaluation globale du risque résiduel
Une fois que toutes les stratégies d’atténuation des risques sont en place et confirmées, le fabricant est tenu d’évaluer le risque total restant associé au dispositif médical. Cette évaluation doit prendre en compte tous les risques restants et les comparer aux avantages de l’utilisation prévue. La méthodologie et les critères d’acceptabilité du risque résiduel global doivent être définis dans le plan de gestion des risques. Dans les cas où le risque résiduel global est jugé acceptable, le fabricant est tenu d’informer les utilisateurs de tout risque résiduel significatif. En outre, ils doivent fournir les informations nécessaires dans la documentation connexe pour communiquer ces risques restants.
Phase post-commercialisation :
La dernière étape du processus, la production et l’information post-production, consiste à contrôler le dispositif médical après sa mise sur le marché afin de s’assurer qu’il continue à répondre aux exigences de sécurité. Cette phase est cruciale, car elle fournira des données en temps réel sur le propre appareil. Un processus de surveillance après la mise sur le marché correctement mis en place est important pour fournir des données solides qui alimentent le processus de gestion des risques.
Importance de l’analyse des risques liés aux dispositifs médicaux
L’analyse des risques liés aux dispositifs médicaux, un élément important du processus de gestion des risques de la norme ISO 14971, implique l’identification et l’analyse des risques potentiels associés à un dispositif médical. Ce processus est essentiel pour garantir la sécurité et l’efficacité d’un dispositif.
L’analyse des risques permet d’identifier les sources potentielles de dommages associés à un dispositif. Ces problèmes peuvent provenir de l’appareil lui-même, de la manière dont il est utilisé ou de l’environnement dans lequel il est utilisé. En identifiant ces risques dès le début du processus de conception, les fabricants peuvent prendre des mesures pour les éliminer ou les atténuer, et ainsi prévenir les incidents susceptibles de causer des dommages.
L’analyse des dangers joue également un rôle crucial dans le processus d’évaluation des risques. En fournissant des informations détaillées sur les dangers potentiels et les risques associés, il permet aux fabricants de prendre des décisions éclairées sur l’acceptabilité de ces risques et la nécessité de prendre des mesures de contrôle des risques. La norme ISO 14971 fournit dans ses annexes des orientations claires pour l’identification systématique des dangers potentiels.
Mise en œuvre de la gestion des risques 14971 dans la conception des produits
La mise en œuvre de la gestion des risques 14971 dans la conception des produits garantit que les dispositifs médicaux sont conçus en tenant compte de la sécurité. La norme ISO 14971 fournit un cadre complet pour la gestion des risques tout au long du processus de conception d’un produit, depuis le concept initial jusqu’au produit final.
La mise en œuvre de la gestion des risques 14971 dans la conception des produits implique l’intégration du processus de gestion des risques dans le processus de conception et de développement. Il s’agit notamment d’identifier les dangers potentiels dès le début du processus de conception, d’estimer et d’évaluer les risques associés, d’élaborer des mesures de contrôle des risques et de contrôler l’efficacité de ces mesures.
En intégrant la gestion des risques dans le processus de conception des produits, les fabricants peuvent s’assurer que les considérations de sécurité font partie intégrante du processus de conception. Cela permet non seulement d’obtenir des produits plus sûrs, mais aussi de réduire la probabilité de rappels de produits et d’actions en responsabilité.
Conclusion
En conclusion, la norme ISO 14971 joue un rôle crucial dans la gestion des risques liés aux dispositifs médicaux. Il fournit un cadre complet pour la gestion des risques associés aux dispositifs médicaux, de la conception initiale au produit final. En encourageant une approche proactive de la conception des produits, fondée sur les risques, elle aide les fabricants à concevoir des dispositifs médicaux sûrs et efficaces.
La mise en œuvre de la norme ISO 14971 dans la conception des produits garantit non seulement la sécurité des dispositifs médicaux, mais contribue également à leur succès. En identifiant et en contrôlant les risques dès le début du processus de conception, les fabricants peuvent prévenir les incidents susceptibles d’entraîner des dommages, réduisant ainsi la probabilité de rappels de produits et d’actions en responsabilité. En outre, en évaluant les risques associés à un dispositif par rapport aux avantages qu’il procure, les fabricants peuvent prendre des décisions éclairées qui contribuent au succès du produit.




