医療機器リスクマネジメント入門
医療機器のリスク管理は、ヘルスケア産業における製品開発の重要な側面であり、機器に関連する潜在的な危険性を特定し、関連するリスクを推定・評価し、これらのリスクを管理し、実施された管理の有効性を監視することが含まれる。 このプロセスは、医療機器の安全性と有効性を確保する上で極めて重要である。 医療機器のリスク管理は、医療機器の安全性について十分な情報に基づいた意思決定を行うための包括的なライフサイクルプロセスである。
医療機器のリスクマネジメントのプロセスは、一過性のものではなく、製品の構想からライフサイクルを通じて継続的に行われるものである。 医療機器に関連するリスクを継続的に評価し、再評価することが必要である。 新たな臨床情報、技術の進歩、規制要件の変更、ユーザーからのフィードバックなどの要因は、機器のリスクプロファイルに影響を与える可能性がある。
しかし、医療機器のリスク管理は、単にリスクを特定し、コントロールするだけではない。 また、機器の利点に対するリスクのバランスをとることも含まれる。 最終的な目標は、患者の安全や機器の性能を損なうことなく、医療機器の利益がそのリスクを上回るようにすることである。
医療機器リスク管理におけるISO 14971の重要性
ISO14971は、医療機器リスクマネジメントの分野で重要な規格であり、医療機器に関連するリスクを管理するための枠組みを提供している。 この規格は世界的に認知されており、ヘルスケア業界の製品開発プロセスにおいて不可欠なものとなっている。 ハザードの特定、関連するリスクの見積もりと評価、リスクのコントロール、コントロールの有効性のモニタリングのための体系的なアプローチを提供する。
医療機器のリスクマネジメントにISO 14971を導入することで、医療機器が最高の安全基準を満たすことが保証される。 これは、製造業者が傷害や危害につながる可能性のあるシナリオを体系的に明らかにし、より安全な製品を設計できるようにするものである。 その上、監査可能なリスク管理の構造化されたアプローチを提供し、これは規制要件の遵守を実証する上で極めて重要である。
ISO14971は、医療機器の設計・開発におけるリスクベースアプローチの重要性を強調するだけでなく、製造業者がリスクマネジメントプロセスを確立する必要性を強調している。 このプロセスは、組織の品質マネジメントシステムに統合されるべきであり、組織の全体的な方針および目的に合致したものでなければならない。
ISO14971リスクマネジメントプロセスの理解
ISO14971リスクマネジメントプロセスは、医療機器のライフサイクル全体を通してリスクを特定、評価、管理、モニタリングするための包括的、体系的、かつ積極的なアプローチである。 このプロセスには、以下を含むいくつかの重要なステップが含まれる。
- リスク分析
- リスク評価
- リスク管理
- プロダクションとポストプロダクションの情報。
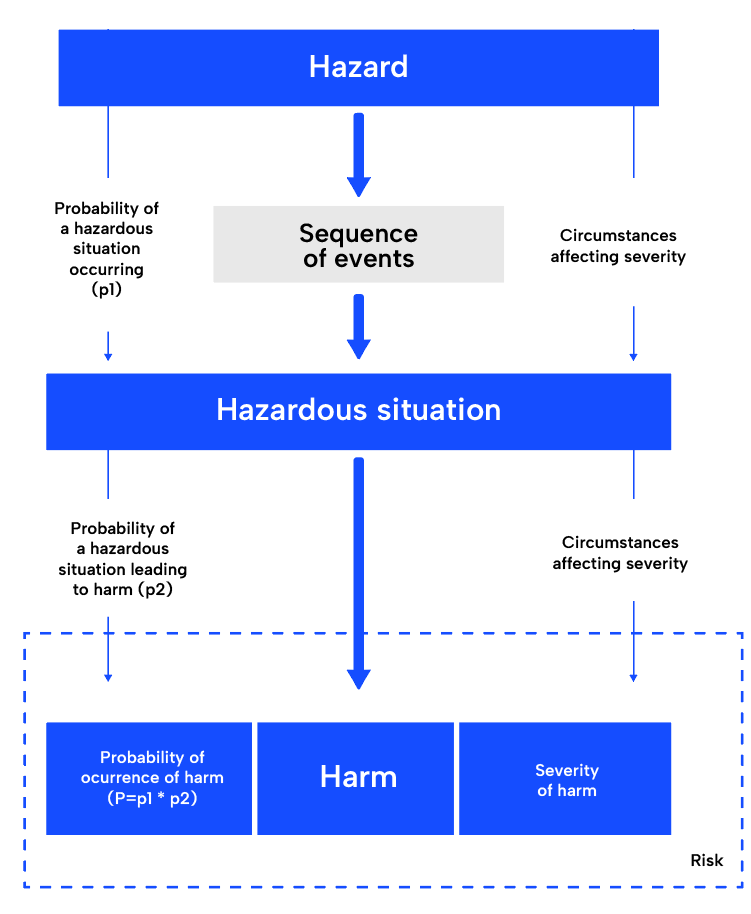
リスク分析:
ISO14971リスクマネジメントプロセスの最初のステップであるリスク分析では、医療機器の使用目的を理解し、潜在的なハザードを特定する。 そのためには、機器、その使用目的、使用中に起こりうる危険性を十分に理解する必要がある。 一旦特定されれば、潜在的に危険な状況と害が導き出される。 一般的なツールは故障モード影響解析(FMEA)である。 このアプローチに従った構造をすでに提供しているので、非常に実用的である。
リスク評価:
次のステップであるリスク評価では、特定された各リスクの重大性と確率を決定し、許容できるか、さらなる管理措置が必要かを決定する。
リスク管理:
プロセスの次の段階であるリスクコントロールでは、許容できないリスクを軽減したり、許容できるリスクをさらに低減したりするための戦略を策定する。 これらの戦略には、医療機器の設計変更、医療機器自体または製造工程における保護措置の提供、リスクに関するユーザーへの情報提供などが含まれる。
総合的な残留リスク評価
すべてのリスク軽減策が実施され、確認された後、製造者は医療機器に関連する残存するリスク全体を評価することが求められる。 この評価では、残存するすべてのリスクを検討し、使用目的の利益と比較すべきである。 残留リスク総計の許容範囲に関する方法論と基準は、リスク管理計画で定義されたものでなければならない。 総体的な残留リスクが許容範囲とみなされる場合、製造者は重大な残留リスクについて使用者に通知する義務がある。 さらに、これらの残されたリスクを伝えるために、関連文書に必要な情報を提供しなければならない。
市販後の段階:
プロセスの最終段階である製造と製造後の情報では、医療機器が安全要件を満たし続けていることを確認するために、市場に出た後の医療機器を監視する。 この段階は、自デバイスのリアルタイムデータを提供するため、非常に重要である。 市販後調査プロセスを適切に設定することは、リスク管理プロセスに反映させる確かなデータを提供するために重要である。
医療機器ハザード分析の重要性
ISO14971リスクマネジメントプロセスの重要な構成要素である医療機器ハザード分析では、医療機器に関連する潜在的なハザードを特定し、分析する。 このプロセスは、機器の安全性と有効性を確保する上で極めて重要である。
ハザード分析は、機器に関連する潜在的な危害源を特定するのに役立つ。 これらは、機器そのもの、使用方法、使用環境から生じる可能性がある。 設計プロセスの早い段階でこうした危険性を特定することで、メーカーはそれを排除または軽減するための措置を講じることができ、その結果、危害につながる事故を未然に防ぐことができる。
ハザード分析もまた、リスク評価プロセスにおいて重要な役割を果たす。 潜在的なハザードとそれに関連するリスクに関する詳細な情報を提供することで、メーカーはこれらのリスクの許容範囲やリスク管理措置の必要性について、十分な情報に基づいた意思決定を行うことができる。 ISO14971は、その附属書において、潜在的なハザードを体系的に特定するための明確なガイダンスを提供している。
製品設計におけるリスクマネジメント14971の導入
製品設計にリスクマネジメント14971を導入することで、医療機器の安全性を考慮した設計が可能となる。 ISO14971規格は、最初のコンセプトから最終製品に至るまで、製品設計プロセス全体でリスクを管理するための包括的な枠組みを提供している。
製品設計にリスクマネジメント14971を導入するには、設計・開発プロセスにリスクマネジメントプロセスを組み込む必要がある。 これには、設計プロセスの早い段階で潜在的なハザードを特定すること、関連するリスクを見積もり評価すること、リスク管理策を策定すること、そしてこれらの対策の有効性を監視することが含まれる。
リスクマネジメントを製品設計プロセスに組み込むことで、メーカーは安全への配慮を設計プロセスの不可欠な部分とすることができる。 これは、より安全な製品を生み出すだけでなく、製品リコールや賠償請求の可能性を減らすことにもつながる。
結論
結論として、ISO 14971規格は医療機器のリスク管理において重要な役割を果たしている。 初期設計から最終製品に至るまで、医療機器に関連するリスクを管理するための包括的な枠組みを提供する。 製品設計にリスクベースの積極的なアプローチを奨励することで、メーカーが安全で効果的な医療機器を設計できるよう支援する。
製品設計にISO 14971規格を導入することは、医療機器の安全性を確保するだけでなく、その成功にも貢献する。 設計プロセスの早い段階でリスクを特定しコントロールすることで、メーカーは危害につながる事故を防ぐことができ、製品リコールや賠償請求の可能性を減らすことができる。 さらに、デバイスに関連するリスクを、それが提供するベネフィットに照らして評価することにより、メーカーは、製品の成功に貢献する情報に基づいた意思決定を行うことができる。
医療機器のリスク管理プロセスにおけるISO 14971の導入に関する詳細については、当社の専門家にお問い合わせください。




