Einführung in das Risikomanagement für Medizinprodukte
Das Risikomanagement für Medizinprodukte, ein entscheidender Aspekt der Produktentwicklung in der Gesundheitsbranche, umfasst die Identifizierung potenzieller Gefahren im Zusammenhang mit einem Produkt, die Abschätzung und Bewertung der damit verbundenen Risiken, die Kontrolle dieser Risiken und die Überwachung der Wirksamkeit der eingeführten Kontrollen. Dieser Prozess ist entscheidend für die Sicherheit und Wirksamkeit von Medizinprodukten. Das Risikomanagement für Medizinprodukte ist ein umfassender, lebenslanger Prozess, der dabei hilft, fundierte Entscheidungen über die Sicherheit von Medizinprodukten zu treffen.
Der Prozess des Risikomanagements von Medizinprodukten ist kein einmaliges Ereignis, sondern ein fortlaufender Prozess, der mit der Konzeption eines Produkts beginnt und sich über dessen gesamten Lebenszyklus erstreckt. Es ist notwendig, die mit einem Medizinprodukt verbundenen Risiken ständig zu bewerten und neu zu beurteilen. Faktoren wie neue klinische Informationen, technologische Fortschritte, Änderungen der gesetzlichen Vorschriften und Rückmeldungen der Anwender können das Risikoprofil eines Produkts beeinflussen.
Beim Risikomanagement für Medizinprodukte geht es jedoch nicht nur um die Ermittlung und Kontrolle von Risiken. Es geht auch darum, Risiken und Nutzen eines Produkts gegeneinander abzuwägen. Letztlich soll sichergestellt werden, dass der Nutzen eines Medizinprodukts seine Risiken überwiegt, ohne die Sicherheit der Patienten oder die Leistung des Produkts zu beeinträchtigen.
Die Bedeutung der ISO 14971 für das Risikomanagement von Medizinprodukten
ISO 14971, eine wichtige Norm im Bereich des Risikomanagements von Medizinprodukten, bietet einen Rahmen für das Risikomanagement von Medizinprodukten. Diese Norm ist weltweit anerkannt und hat sich zu einem wesentlichen Bestandteil des Produktentwicklungsprozesses in der Gesundheitsbranche entwickelt. Es bietet einen systematischen Ansatz zur Identifizierung von Gefahren, zur Abschätzung und Bewertung der damit verbundenen Risiken, zur Kontrolle dieser Risiken und zur Überwachung der Wirksamkeit der Kontrollen.
Die Umsetzung der ISO 14971 im Risikomanagement für Medizinprodukte gewährleistet, dass ein Medizinprodukt den höchsten Sicherheitsstandards entspricht. Es hilft den Herstellern, systematisch Szenarien aufzudecken, die zu Verletzungen oder Schäden führen könnten, und ermöglicht es ihnen, sicherere Produkte zu entwickeln. Außerdem bietet es einen strukturierten Ansatz für das Risikomanagement, der geprüft werden kann, was für den Nachweis der Einhaltung der gesetzlichen Vorschriften von entscheidender Bedeutung ist.
Die ISO 14971 betont nicht nur die Bedeutung eines risikobasierten Ansatzes bei der Konzeption und Entwicklung von Medizinprodukten, sondern unterstreicht auch die Notwendigkeit für die Hersteller, ein Risikomanagementverfahren einzuführen. Dieser Prozess sollte in das Qualitätsmanagementsystem der Organisation integriert werden und mit der allgemeinen Politik und den Zielen der Organisation übereinstimmen.
Verständnis des Risikomanagementprozesses nach ISO 14971
Der Risikomanagementprozess nach ISO 14971 ist ein umfassender, systematischer und proaktiver Ansatz zur Identifizierung, Bewertung, Kontrolle und Überwachung von Risiken während des gesamten Lebenszyklus eines Medizinprodukts. Der Prozess umfasst mehrere wichtige Schritte, darunter
- Risikoanalyse,
- Risikobewertung,
- Risikokontrolle, und
- Informationen zur Produktion und Postproduktion.
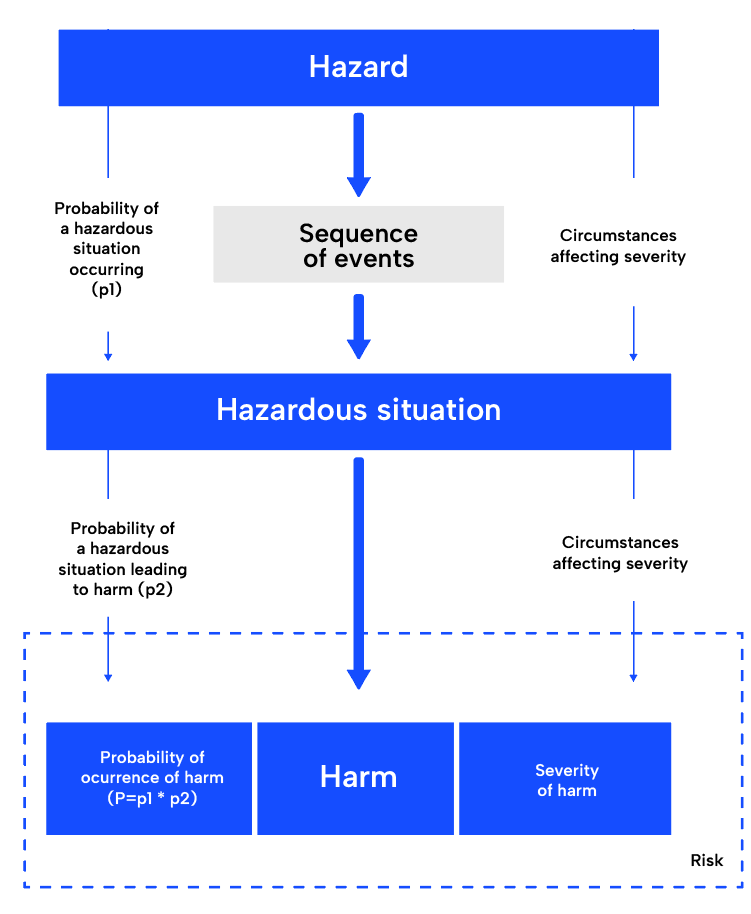
Risikoanalyse:
Der erste Schritt im Risikomanagementprozess nach ISO 14971, die Risikoanalyse, beinhaltet das Verständnis der beabsichtigten Verwendung des Medizinprodukts und die Identifizierung potenzieller Gefahren. Sie erfordert ein gründliches Verständnis des Produkts, seiner bestimmungsgemäßen Verwendung und der potenziellen Gefahren, die bei seiner Verwendung auftreten können. Sobald sie identifiziert sind, werden die potenziell gefährlichen Situationen und die Schäden abgeleitet. Ein gängiges Instrument ist die Fehlermöglichkeits- und -einflussanalyse (FMEA). Es ist sehr praktisch, da es bereits eine Struktur bietet, die diesem Ansatz folgt.
Risikobewertung:
Der nächste Schritt, die Risikobewertung, beinhaltet die Bestimmung des Schweregrads und der Wahrscheinlichkeit jedes identifizierten Risikos und die Entscheidung, ob es akzeptabel ist oder weitere Kontrollmaßnahmen erfordert.
Risikokontrolle:
Die Risikokontrolle, der nächste Schritt im Prozess, umfasst die Entwicklung von Strategien zur Abschwächung inakzeptabler Risiken oder zur weiteren Reduzierung selbst akzeptabler Risiken. Diese Strategien können Änderungen in der Auslegung des Produkts, Schutzmaßnahmen im Medizinprodukt selbst oder im Herstellungsprozess und die Information der Anwender über die Risiken umfassen.
Gesamtbewertung des Restrisikos
Sobald alle Risikominderungsstrategien vorhanden und bestätigt sind, muss der Hersteller das mit dem Medizinprodukt verbundene Restrisiko bewerten. Bei dieser Bewertung sollten alle verbleibenden Risiken berücksichtigt und mit den Vorteilen der geplanten Verwendung verglichen werden. Die Methodik und die Kriterien für die Annehmbarkeit des aggregierten Restrisikos sollten im Risikomanagementplan festgelegt werden. In den Fällen, in denen das Gesamtrestrisiko als akzeptabel angesehen wird, ist der Hersteller verpflichtet, die Anwender über alle signifikanten Restrisiken zu informieren. Darüber hinaus müssen sie in den entsprechenden Unterlagen die notwendigen Informationen bereitstellen, um diese verbleibenden Risiken zu kommunizieren.
Phase nach der Markteinführung:
Der letzte Schritt des Prozesses, die Informationen über die Produktion und die Zeit nach der Produktion, umfasst die Überwachung des Medizinprodukts, nachdem es auf den Markt gebracht wurde, um sicherzustellen, dass es weiterhin den Sicherheitsanforderungen entspricht. Diese Phase ist von entscheidender Bedeutung, da sie Echtzeitdaten des eigenen Geräts liefern wird. Ein ordnungsgemäß eingerichteter Prozess der Überwachung nach dem Inverkehrbringen ist wichtig, um solide Daten für den Risikomanagementprozess zu liefern.
Bedeutung der Gefährdungsanalyse für Medizinprodukte
Die Gefahrenanalyse für Medizinprodukte, ein wesentlicher Bestandteil des Risikomanagementprozesses nach ISO 14971, umfasst die Identifizierung und Analyse potenzieller Gefahren, die mit einem Medizinprodukt verbunden sind. Dieser Prozess ist entscheidend für die Sicherheit und Wirksamkeit eines Produkts.
Die Gefahrenanalyse hilft bei der Identifizierung potenzieller Gefahrenquellen im Zusammenhang mit einem Produkt. Diese können durch das Gerät selbst, durch die Art seiner Verwendung oder durch die Umgebung, in der es verwendet wird, entstehen. Durch die frühzeitige Erkennung dieser Gefahren im Konstruktionsprozess können die Hersteller Maßnahmen ergreifen, um sie zu beseitigen oder zu entschärfen und so Zwischenfälle zu verhindern, die zu Schäden führen könnten.
Auch bei der Risikobewertung spielt die Gefährdungsanalyse eine entscheidende Rolle. Durch die Bereitstellung detaillierter Informationen über potenzielle Gefahren und die damit verbundenen Risiken können die Hersteller fundierte Entscheidungen über die Akzeptanz dieser Risiken und die Notwendigkeit von Risikokontrollmaßnahmen treffen. Die ISO 14971 bietet in ihren Anhängen klare Anleitungen zur systematischen Ermittlung potenzieller Gefahren.
Implementierung des Risikomanagements 14971 im Produktdesign
Die Umsetzung des Risikomanagements 14971 in der Produktentwicklung gewährleistet, dass Medizinprodukte sicherheitsorientiert entwickelt werden. Die Norm ISO 14971 bietet einen umfassenden Rahmen für das Risikomanagement während des gesamten Produktentwicklungsprozesses, vom ersten Konzept bis zum Endprodukt.
Die Umsetzung des Risikomanagements 14971 in der Produktentwicklung beinhaltet die Integration des Risikomanagementprozesses in den Design- und Entwicklungsprozess. Dazu gehören die frühzeitige Identifizierung potenzieller Gefahren im Planungsprozess, die Abschätzung und Bewertung der damit verbundenen Risiken, die Entwicklung von Maßnahmen zur Risikokontrolle und die Überwachung der Wirksamkeit dieser Maßnahmen.
Durch die Integration des Risikomanagements in den Produktentwicklungsprozess können die Hersteller sicherstellen, dass Sicherheitsüberlegungen ein integraler Bestandteil des Entwicklungsprozesses sind. Dies führt nicht nur zu sichereren Produkten, sondern verringert auch die Wahrscheinlichkeit von Produktrückrufen und Haftungsansprüchen.
Schlussfolgerung
Zusammenfassend lässt sich sagen, dass die Norm ISO 14971 eine entscheidende Rolle beim Risikomanagement von Medizinprodukten spielt. Es bietet einen umfassenden Rahmen für das Management von Risiken im Zusammenhang mit Medizinprodukten, von der ersten Konzeption bis zum Endprodukt. Durch die Förderung eines proaktiven, risikobasierten Ansatzes bei der Produktgestaltung hilft sie den Herstellern, sichere und wirksame Medizinprodukte zu entwickeln.
Die Umsetzung der Norm ISO 14971 bei der Produktgestaltung gewährleistet nicht nur die Sicherheit von Medizinprodukten, sondern trägt auch zu deren Erfolg bei. Durch die frühzeitige Erkennung und Kontrolle von Risiken im Entwicklungsprozess können Hersteller Vorfälle, die zu Schäden führen könnten, verhindern und so die Wahrscheinlichkeit von Produktrückrufen und Haftungsansprüchen verringern. Darüber hinaus können die Hersteller durch die Abwägung der mit einem Produkt verbundenen Risiken gegen den Nutzen, den es bietet, fundierte Entscheidungen treffen, die zum Erfolg des Produkts beitragen.
Sprechen Sie noch heute mit unseren Experten, wenn Sie mehr über die Umsetzung der ISO 14971 in Ihrem Risikomanagementprozess für Medizinprodukte erfahren möchten.




