Introdução à Gestão de Riscos dos Dispositivos Médicos
A gestão do risco dos dispositivos médicos, um aspeto crítico do desenvolvimento de produtos na indústria dos cuidados de saúde, envolve a identificação de potenciais perigos associados a um dispositivo, a estimativa e avaliação dos riscos associados, o controlo desses riscos e a monitorização da eficácia dos controlos implementados. Este processo é fundamental para garantir a segurança e a eficácia dos dispositivos médicos. A gestão do risco dos dispositivos médicos é um processo abrangente e de ciclo de vida que ajuda a tomar decisões informadas sobre a segurança dos dispositivos médicos.
O processo de gestão do risco dos dispositivos médicos não é um acontecimento único, mas sim um processo contínuo que começa na conceção de um produto e continua ao longo do seu ciclo de vida. É necessário avaliar e reavaliar continuamente os riscos associados a um dispositivo médico. Factores como novas informações clínicas, avanços tecnológicos, alterações nos requisitos regulamentares e feedback dos utilizadores podem afetar o perfil de risco de um dispositivo.
No entanto, a gestão dos riscos dos dispositivos médicos não se limita a identificar e controlar os riscos. Envolve também o equilíbrio entre os riscos e os benefícios de um dispositivo. O objetivo final é garantir que os benefícios de um dispositivo médico superam os seus riscos, sem comprometer a segurança dos doentes ou o desempenho do dispositivo.
Importância da ISO 14971 na Gestão de Riscos de Produtos médicos
A ISO 14971, uma norma fundamental no domínio da gestão do risco dos dispositivos médicos, fornece um quadro para a gestão dos riscos relacionados com os dispositivos médicos. Esta norma é reconhecida mundialmente e tornou-se uma parte essencial do processo de desenvolvimento de produtos no sector da saúde. Fornece uma abordagem sistemática para identificar os perigos, estimar e avaliar os riscos associados, controlar esses riscos e monitorizar a eficácia dos controlos.
A implementação da ISO 14971 na gestão de riscos dos dispositivos médicos garante que um dispositivo médico cumpre as mais elevadas normas de segurança. Ajuda os fabricantes a descobrir sistematicamente cenários que podem conduzir a lesões ou danos, permitindo-lhes conceber produtos mais seguros. Além disso, fornece uma abordagem estruturada à gestão do risco que pode ser auditada, o que é crucial para demonstrar a conformidade com os requisitos regulamentares.
A ISO 14971 não só sublinha a importância de uma abordagem baseada no risco para a conceção e desenvolvimento de dispositivos médicos, como também destaca a necessidade de os fabricantes estabelecerem um processo de gestão do risco. Este processo deve ser integrado no sistema de gestão da qualidade da organização e deve ser coerente com a política e os objectivos globais da organização.
Compreender o processo de gestão de riscos da ISO 14971
O processo de gestão de riscos da ISO 14971 é uma abordagem abrangente, sistemática e proactiva para identificar, avaliar, controlar e monitorizar os riscos ao longo do ciclo de vida de um dispositivo médico. O processo envolve várias etapas fundamentais, incluindo
- análise de risco,
- avaliação dos riscos,
- controlo de riscos, e
- informações sobre a produção e a pós-produção.
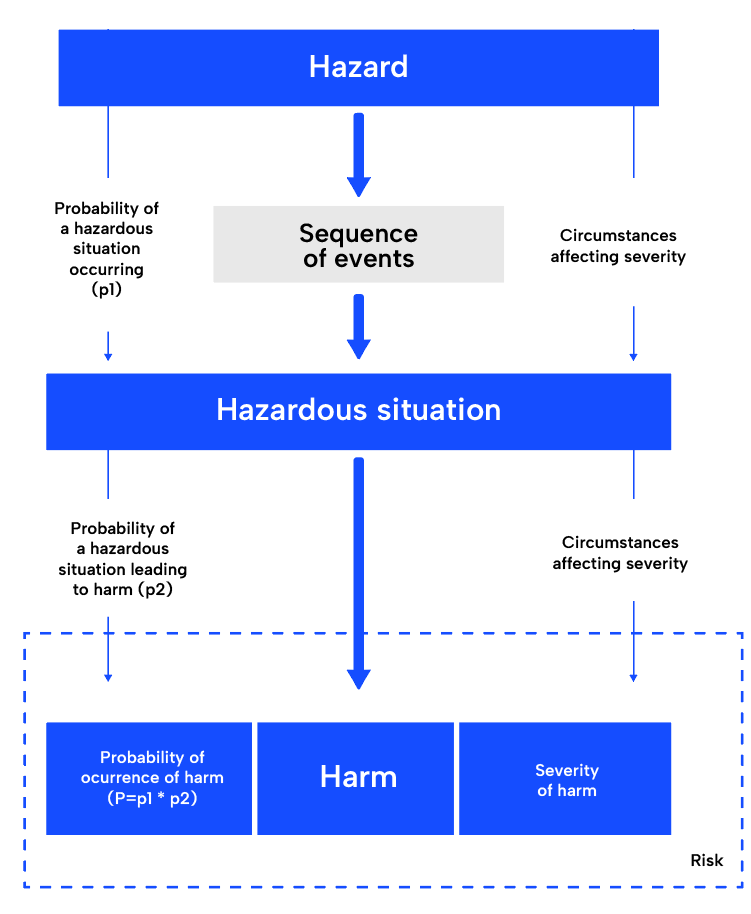
Análise de risco:
O primeiro passo no processo de gestão de riscos da ISO 14971, a análise de riscos, envolve a compreensão da utilização prevista do dispositivo médico e a identificação de potenciais perigos. Exige um conhecimento profundo do dispositivo, da sua utilização prevista e dos potenciais perigos que podem surgir durante a sua utilização. Uma vez identificadas, as situações potencialmente perigosas e os danos serão derivados. Uma ferramenta comum é a análise dos modos de falha e dos efeitos (FMEA). É muito prático, pois já fornece uma estrutura que segue esta abordagem.
Avaliação dos riscos:
A etapa seguinte, a avaliação do risco, consiste em determinar a gravidade e a probabilidade de cada risco identificado e decidir se é aceitável ou se necessita de medidas de controlo adicionais.
Controlo dos riscos:
O controlo dos riscos, a etapa seguinte do processo, implica o desenvolvimento de estratégias para atenuar os riscos inaceitáveis ou reduzir ainda mais os riscos aceitáveis. Estas estratégias podem incluir alterações na conceção do dispositivo, medidas de proteção no próprio dispositivo médico ou no processo de fabrico e informação aos utilizadores sobre os riscos.
Avaliação global do risco residual
Quando todas as estratégias de redução do risco estiverem implementadas e confirmadas, o fabricante deve avaliar o risco total remanescente associado ao dispositivo médico. Esta avaliação deve considerar todos os riscos remanescentes e compará-los com os benefícios da utilização pretendida. A metodologia e os critérios de aceitabilidade do risco residual agregado devem ser os definidos no plano de gestão dos riscos. Nos casos em que o risco residual agregado é considerado aceitável, o fabricante é obrigado a notificar os utilizadores sobre quaisquer riscos residuais significativos. Além disso, devem fornecer as informações necessárias na documentação relacionada para comunicar esses riscos remanescentes.
Fase pós-comercialização:
A última etapa do processo, a informação sobre a produção e a pós-produção, envolve a monitorização do dispositivo médico depois de ter sido lançado no mercado para garantir que continua a cumprir os requisitos de segurança. Esta fase é crucial, uma vez que fornecerá dados em tempo real do próprio dispositivo. Um processo de vigilância pós-comercialização corretamente estabelecido é importante para fornecer dados sólidos para alimentar o processo de gestão do risco.
Importância da Análise de Perigos para Produtos médicos
A análise de perigos de dispositivos médicos, um componente significativo do processo de gestão de riscos da ISO 14971, envolve a identificação e análise de potenciais perigos associados a um dispositivo médico. Este processo é crucial para garantir a segurança e a eficácia de um dispositivo.
A análise de perigos ajuda a identificar potenciais fontes de danos associadas a um dispositivo. Estas podem resultar do próprio dispositivo, da forma como é utilizado ou do ambiente em que é utilizado. Ao identificar estes perigos numa fase inicial do processo de conceção, os fabricantes podem tomar medidas para os eliminar ou atenuar, prevenindo assim incidentes que possam causar danos.
A análise de perigos também desempenha um papel crucial no processo de avaliação de riscos. Ao fornecer informações pormenorizadas sobre os perigos potenciais e os riscos associados, permite que os fabricantes tomem decisões informadas sobre a aceitabilidade desses riscos e a necessidade de medidas de controlo dos riscos. A norma ISO 14971 fornece, nos seus anexos, orientações claras para identificar sistematicamente os perigos potenciais.
Implementação da Gestão do Risco 14971 na Conceção de Produtos
A implementação da gestão de riscos 14971 na conceção dos produtos garante que os dispositivos médicos são concebidos tendo em conta a segurança. A norma ISO 14971 fornece um quadro abrangente para a gestão de riscos ao longo do processo de conceção do produto, desde o conceito inicial até ao produto final.
A implementação da gestão do risco 14971 na conceção de produtos implica a integração do processo de gestão do risco no processo de conceção e desenvolvimento. Isto inclui a identificação de potenciais perigos no início do processo de conceção, a estimativa e avaliação dos riscos associados, o desenvolvimento de medidas de controlo dos riscos e a monitorização da eficácia dessas medidas.
Ao integrar a gestão do risco no processo de conceção do produto, os fabricantes podem garantir que as considerações de segurança são parte integrante do processo de conceção. Isto não só resulta em produtos mais seguros, como também reduz a probabilidade de recolha de produtos e de reclamações de responsabilidade.
Conclusão
Em conclusão, a norma ISO 14971 desempenha um papel crucial na gestão dos riscos dos dispositivos médicos. Fornece um quadro abrangente para a gestão dos riscos associados aos dispositivos médicos, desde a conceção inicial até ao produto final. Ao encorajar uma abordagem proactiva e baseada no risco à conceção dos produtos, ajuda os fabricantes a conceberem dispositivos médicos seguros e eficazes.
A implementação da norma ISO 14971 na conceção dos produtos não só garante a segurança dos dispositivos médicos, como também contribui para o seu sucesso. Ao identificar e controlar os riscos numa fase inicial do processo de conceção, os fabricantes podem evitar incidentes que possam causar danos, reduzindo assim a probabilidade de recolhas de produtos e de pedidos de indemnização. Além disso, ao avaliar os riscos associados a um dispositivo em relação aos benefícios que ele proporciona, os fabricantes podem tomar decisões informadas que contribuem para o sucesso do produto.
Fale com os nossos especialistas hoje para obter mais informações sobre a implementação da ISO 14971 no seu processo de gestão de riscos de dispositivos médicos.




